2025年3月19日,國家藥監(jiān)局發(fā)布《藥品試驗數(shù)據(jù)保護(hù)實施辦法(試行,征求意見稿)》、《藥品試驗數(shù)據(jù)保護(hù)工作程序(征求意見稿)》,明確對創(chuàng)新藥、改良型新藥、3類仿制藥分別給予6年、3年、3年的數(shù)據(jù)保護(hù)期。在數(shù)據(jù)保護(hù)期內(nèi),其他申請人未經(jīng)藥品上市許可持有人同意,依賴前款數(shù)據(jù)申請藥品上市許可或者補(bǔ)充申請的,國家藥監(jiān)局不予許可(自行取得數(shù)據(jù)的除外),為藥物研發(fā)筑起市場“護(hù)城河”。
征求意見落地后,以政策導(dǎo)向為主的國內(nèi)醫(yī)藥行業(yè),或許將在發(fā)展方向和管線布局方面發(fā)生明顯變化。
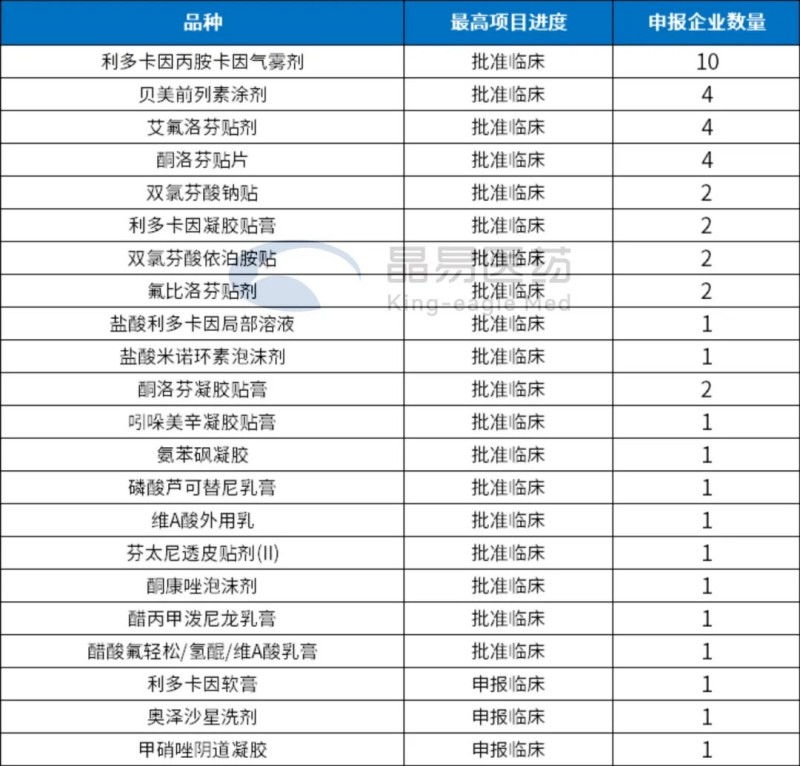
我們對3類經(jīng)皮給藥制劑進(jìn)行了統(tǒng)計,數(shù)據(jù)如下:
按品種統(tǒng)計:
已申請臨床但未上市的3類經(jīng)皮給藥制劑覆蓋22個品種,涉及皮膚抗炎、鎮(zhèn)痛、抗感染等高需求領(lǐng)域。
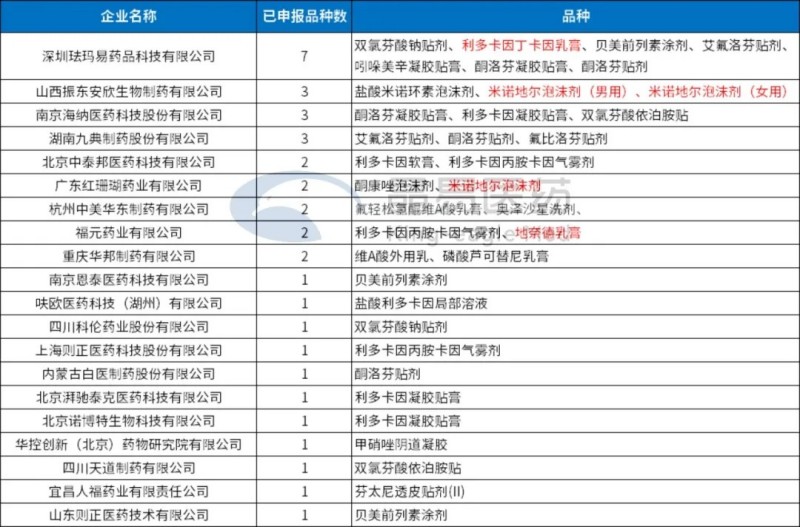
按企業(yè)統(tǒng)計:
注:紅色為已有企業(yè)報產(chǎn)的品種
有3類經(jīng)皮給藥制劑申報的前20個企業(yè)中,深圳琺瑪易藥品科技有限公司已申報7個3類品種,品種數(shù)居首位。
晶易醫(yī)藥作為經(jīng)皮及黏膜給藥領(lǐng)域的CRO領(lǐng)軍企業(yè),在多個3類經(jīng)皮給藥品種上具備突出研發(fā)優(yōu)勢,可以為企業(yè)提供定制化解決方案。